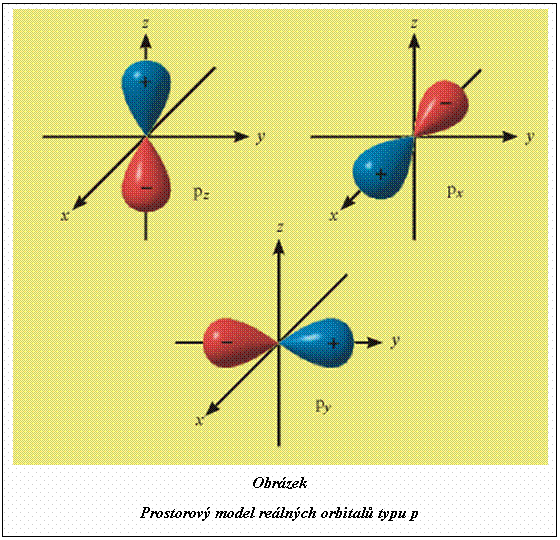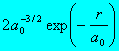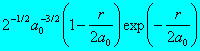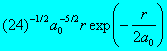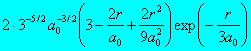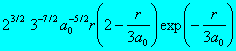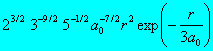![]() 2.1 Znázornění atomových orbitalů
2.1 Znázornění atomových orbitalů
Atomové orbitaly je možno znázornit různými způsoby.
Radiální část vlnové funkce pro několik prvních hodnot kvantových čísel n a l je uvedena v tabulce:
|
n |
l |
Rnl(r) |
|
1 |
0 |
|
|
2 |
0 |
|
|
2 |
1 |
|
|
3 |
0 |
|
|
3 |
1 |
|
|
3 |
2 |
|
Angulární část vlnové funkce představují tzv. kulové funkce (též sférické funkce), jejichž tvar pro několik prvních hodnot l a m je uveden v tabulce:
|
L |
m |
Ynl(q, j ) |
|
0 |
0 |
|
|
1 |
0 |
|
|
1 |
±1 |
|
|
2 |
0 |
|
|
2 |
±1 |
|
|
2 |
±2 |
|
Kulové funkce jsou funkcemi dvou úhlů, navíc se jedná o
komplexní funkce, proto je jejich znázornění obtížnější než v případě
radiální vlnové funkce. Z tohoto důvodu se znázorňuje většinou veličina ![]() , která už je reálnou funkcí a navíc závisí jen na úhlu
, která už je reálnou funkcí a navíc závisí jen na úhlu ![]() . Výraz
. Výraz ![]() má význam
pravděpodobnosti nalezení elektronu ve směrech určených úhly mezi
má význam
pravděpodobnosti nalezení elektronu ve směrech určených úhly mezi ![]() a
a ![]() a mezi
a mezi ![]() a
a![]() . Jinak řečeno, jde o pravděpodobnost nalezení elektronu
v elementu prostorového úhlu
. Jinak řečeno, jde o pravděpodobnost nalezení elektronu
v elementu prostorového úhlu ![]() . Funkci |Ynl|2
je možno znázornit ve formě polárního diagramu, tj. ve směru daném
úhly
. Funkci |Ynl|2
je možno znázornit ve formě polárního diagramu, tj. ve směru daném
úhly ![]() a
a ![]() se vykreslují body ve
vzdálenosti
se vykreslují body ve
vzdálenosti ![]() od počátku. Graf tedy
představuje plochu v prostoru. Vzhledem k tomu, že
od počátku. Graf tedy
představuje plochu v prostoru. Vzhledem k tomu, že ![]() závisí pouze na úhlu
závisí pouze na úhlu ![]() , je tato plocha symetrická podle osy z. Pro získání
představy o tvaru funkce
, je tato plocha symetrická podle osy z. Pro získání
představy o tvaru funkce ![]() stačí znázornit řez
s libovolnou rovinou procházející osou z, např. rovinnou xz (
stačí znázornit řez
s libovolnou rovinou procházející osou z, např. rovinnou xz (![]() ).
).
Znázornění celých atomových orbitalů (AO) je podstatně těžší než zobrazení samostatné radiální části AO nebo angulární části AO. Jedná se o komplexní funkce tří proměnných r, q a j. Abychom nemuseli zobrazovat reálnou a imaginární část AO , volí se pro zobrazení
a)
hustota pravděpodobnosti nalezení elektronu v bodě
![]() , tedy veličina
, tedy veličina ![]() ,
,
b)
reálné atomové orbitaly
![]() ,
které se získají vhodnou lineární kombinací původních (komplexních) atomových
orbitalů
,
které se získají vhodnou lineární kombinací původních (komplexních) atomových
orbitalů ![]() s pevnou
hodnotou n a l ,
ale různou hodnotou m,
s pevnou
hodnotou n a l ,
ale různou hodnotou m,
c)
hustota pravděpodobnosti nalezení elektronu v bodě
![]() pro stavy odpovídající reálným atomovým
orbitalům z bodu b),
pro stavy odpovídající reálným atomovým
orbitalům z bodu b),
![]() (viz též následující kapitolu).
(viz též následující kapitolu).
V případě b se využívá skutečnosti, že libovolná
lineární kombinace řešení bezčasové Schrödingerovy rovnice
je rovněž jejím řešením. Reálné orbitaly pro dané n a l už
ovšem nejsou na rozdíl od původních funkcí vlastními funkcemi operátoru z-ové
komponenty orbitálního momentu hybnosti ![]() . Obecně tedy nepopisují stavy s určitou hodnotu
. Obecně tedy nepopisují stavy s určitou hodnotu ![]() . Např. reálné AO typu p dostaneme kombinacemi:
. Např. reálné AO typu p dostaneme kombinacemi:
![]() ,
,