![]() 1.5.1 Objasnění čárového spektra
1.5.1 Objasnění čárového spektra
Při odvození emisního, resp.
absorpčního spektra atomu vodíku vycházíme ze znalosti jeho energetického
spektra a skutečnosti, že k emisi, resp. absorpci elektromagnetického
záření může dojít dle Bohrových předpokladů pouze
při přechodu z vyšší energetické hladiny na nižší (emise fotonu,
deexcitace atomu), resp. z nižší energetické hladiny na hladinu vyšší (absorpce
fotonu, excitace atomu). Energie fotonu ![]() , tj. kvanta elektromagnetického záření, je v obou
případech podle zákona zachování energie rovna změně energie atomu, tedy při
přechodu z j-té hladiny na i-tou
, tj. kvanta elektromagnetického záření, je v obou
případech podle zákona zachování energie rovna změně energie atomu, tedy při
přechodu z j-té hladiny na i-tou ![]() . Podle Einsteinovy
fotonové hypotézy je úhlová frekvence fotonu
. Podle Einsteinovy
fotonové hypotézy je úhlová frekvence fotonu ![]() (pro kmitočet
(pro kmitočet ![]() ). Po dosazení vztahu pro energetické spektrum atomu vodíku tedy
dostáváme:
). Po dosazení vztahu pro energetické spektrum atomu vodíku tedy
dostáváme:
![]() .
.
Ve spektroskopii se používá tzv.
vlnočet, což je reciproká hodnota vlnové délky
![]() . Mezi kmitočtem a vlnovou délkou fotonu platí vztah
. Mezi kmitočtem a vlnovou délkou fotonu platí vztah ![]() , kde c je rychlost světla ve vakuu, a
tedy
, kde c je rychlost světla ve vakuu, a
tedy ![]() . Potom je možno zapsat vztah pro vlnočet
. Potom je možno zapsat vztah pro vlnočet
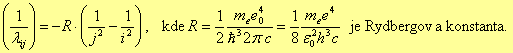
Stejně jako v případě energetického spektra lze provést opravu na pohyb jádra zavedením nahrazením hmotnosti elektronu redukovanou hmotností.
Odvozené spektrum je graficky znázorněno na obrázku: Bohrův model atomu. Obrázek kromě energetických hladin v Bohrově modelu atomu ukazuje souvislost sérií spektrálních čar s přechody mezi těmito hladinami při emisi, nebo naopak absorpci, fotonu atomem.
Odvozené spektrum v hlavních rysech odpovídalo tomu, co bylo pozorováno v experimentu. Při použití spektroskopů s vyšším rozlišením se ale čáry rozpadají na několik blízkých čar, je pozorovatelná tzv. jemná a hyperjemná struktura spektra.