![]() 1.1 Základní chemické zákony
1.1 Základní chemické zákony
Pro zrod atomové teorie vytvořilo předpoklady formulování základních chemických zákonů. Mezi tyto zákony patří:
·
Zákon zachování hmotnosti
Poprvé tento zákon formuloval Lomonosov (1748) a později nezávisle na něm Lavoisier (1774).
·
Zákon zachování energie
Zákon opět poprvé formuloval Lomonosov (1748), ve známost vstoupil až po novější, nezávislé formulaci Mayerem (1842).
Změny hmotnosti, které odpovídají měřitelným změnám energie při chemických reakcích, jsou tak malé, že je prakticky nelze detekovat.
Sloučením 1 g vodíku s přibližně 8 g
kyslíku na vodu se uvolní energie ![]() , což odpovídá snížení hmotnosti o
, což odpovídá snížení hmotnosti o ![]() .
.
·
Zákon stálých poměrů slučovacích
Zákon byl formulován nezávisle Proustem a Daltonem (1799).
Například ve vodě je
poměr hmotností kyslíku a vodíku přibližně 8 : 1.
·
Zákon násobných poměrů slučovacích
Zákon byl formulován nezávisle Richterem (1791) a Daltonem (1802).
Kyslík, který se sloučí
bezezbytku s 1 g vodíku na vodu, má hmotnost asi 8 g. Kyslík, který se sloučí
bezezbytku s 1 g vodíku na peroxid vodíku, má hmotnost přibližně 16 g. Poměr
uvedených hmotností kyslíku je 1:2.
·
Zákon stálých poměrů objemových
Zákon formuloval Gay-Lussac (1805).
Kyslík s objemem
![]() se bezezbytku sloučí s vodíkem
o objemu
se bezezbytku sloučí s vodíkem
o objemu
![]() na vodu ve formě páry o objemu
na vodu ve formě páry o objemu
![]() .
.
·
Zákon Avogadrův
Tento zákon formuloval Avogadro spolu se zavedením pojmu molekula.
Z platnosti zákona stálých poměrů objemových (viz uvedený
příklad) a Avogadrova zákona vyplývá existence dvouatomových molekul vodíku a
kyslíku.
Zavedení pojmu molekula si vyžádala i kinetická teorie. Její vztahy dávají správné výsledky, jen když budeme
považovat za základní částice látek, které v této teorii vystupují,
molekuly (nikoliv atomy). V případě prvků, s výjimkou vzácných plynů,
které mají jednoatomové molekuly, to musí být molekuly tvořené více atomy daného
prvku. Nejčastěji jsou to dvouatomové molekuly jako např. u dusíku, kyslíku
nebo vodíku.
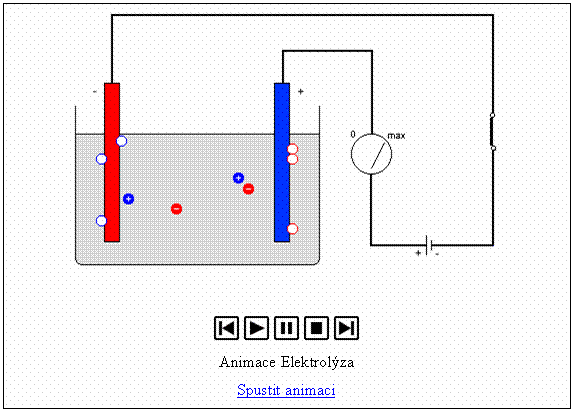
Nejmenší náboj přenesený při elektrolýze je roven elementárnímu elektrickému náboji e, což je důkazem kvantování elektrického náboje.
Dnes můžeme na základě atomistických představ psát
![]() ,
kde mr je relativní
atomová hmotnost daného atomu, Z je
stupeň ionizace atomu (iontu) v elektrolytu (odpovídá mocenství), u
je atomová hmotnostní konstanta a e elementární
elektrický náboj. Platí totiž
,
kde mr je relativní
atomová hmotnost daného atomu, Z je
stupeň ionizace atomu (iontu) v elektrolytu (odpovídá mocenství), u
je atomová hmotnostní konstanta a e elementární
elektrický náboj. Platí totiž
![]() , kde N je počet prošlých iontů (kationtů či aniontů),
a tedy i atomů vyloučených na příslušné elektrodě (katodě či anodě). Nositeli
elektrického náboje v elektrolytu jsou ionty s nábojem Ze ,
které na elektrodě zachytí či odevzdají elektrony a vylučují se jako atomy
s hmotností mru.
, kde N je počet prošlých iontů (kationtů či aniontů),
a tedy i atomů vyloučených na příslušné elektrodě (katodě či anodě). Nositeli
elektrického náboje v elektrolytu jsou ionty s nábojem Ze ,
které na elektrodě zachytí či odevzdají elektrony a vylučují se jako atomy
s hmotností mru.
Tyto látky
se označují jako reaktanty.
Na počátku
19. století byly odchylky skutečných hodnot poměrů od hodnoty příslušného
podílu celých čísel v rámci přesnosti tehdejších měřících metod. Na
základě současných přesnějších měření víme, že poměry se od podílu celých čísel
o něco málo liší, což souvisí s rozdílem v hmotnosti neutronů a protonů a
hmotnostním úbytkem jádra atomu.
Tato
veličina je pro danou látku konstantní
Elementární elektrický náboj -
nejmenší přenesený náboj
Celkový přenesený náboj je tedy pouze celistvým násobkem e.