
Izochorický děj
Při tomto ději nemůžeme volně měnit objem V, ale teplotu T a tlak p. I tento děj je popisován zákonem, který byl dříve odvozen experimentálně jako Charlesův zákon. Odvodíme ho ze stavové rovnice analogicky jako pro izotermický a izobarický děj. Popisuje závislost tlaku na teplotě.
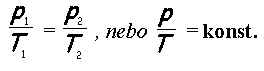
Charlesův zákon. Tlak plynu při izochorickém ději je přímo úměrný termodynamické teplotě.
Průběh izochorického děje můžeme zakreslit do grafu. Analogicky s předchozími ději zde nazýváme křivku
izochora.Je-li stálý objem plynu, tak soustava nemůže konat práci. Pro vnitřní energii platí vztah
U = cV
DT + U0U0
je počáteční vnitřní energie. Vnitřní energie závisí na teplotě a nikoliv na objemu a tlaku.Poznámka.
Porovnejme energetické bilance u izochorického a izobarického děje. Teplo potřebné k zahřátí plynu při izobarickém zahřívání je větší než teplo potřebné k ohřátí téhož plynu izochoricky. Rozdíl je dán prací W = pDV .




