
Izobarický děj
Neměnný je tlak
p, naopak termodynamická teplota T a objem V nabývají různé hodnoty. V počátečním a koncovém stavu je tlak shodný. Do stavové rovnice můžeme dosadit za tlak p1 = p2 = p. U izobarického děje přepisujeme stavovou rovnici do tvaru tzv. Gay-Lussacova zákona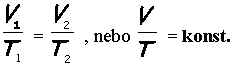
Gay-Lussacův zákon. Poměr objemu a teploty ideálního plynu při izobarickém ději je v každém okamžiku stejný.
I průběh izobarického děje můžeme zaznamenat na grafu. Výsledná křivka se nazývá
izobara. Podívejme se na energetickou bilanci izobarického děje. Teplo přijaté soustavou je rovno součtu přírůstku vnitřní energie soustavy a práce vykonané soustavou.Q = DU + W
Pro jeden mol plynu pak platí
Q = CV
DT + pV





