Stavová rovnice ideálního plynu vyjadřuje vzájemný vztah mezi termodynamickou teplotou
T, objemem V, tlakem p a látkovým množstvím n. Termodynamická soustava musí být v rovnovážném stavu. Obecně můžeme za stavovou rovnici považovat každý vztah vyjadřující závislost vnitřních a vnějších parametrů soustavy. Látkové množství můžeme nahradit například hmotností m. Stavová rovnice se nejběžněji uvádí pro 1 mol.Pro odvození rovnice v
yužijeme vzahy známé z předešlých kapitol. Využijeme vztah pro střední kvadratickou rychlost molekul a pro střední tlak plynu. Dosadíme-li do výrazu pro tlak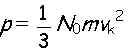
za střední kvadratickou rychlost
![]() ,
,
Počet molekul je definován vztahem N = nNA, kde NA je Avogardova konstanta (NA = 6,022 × 1023 mol-1). Potom obdržíme další možný tvar stavové rovnice
pV = nN
AkT Součin Boltzmannovy a Avogardovy konstanty nahradíme konstantou novou. Značíme ji R a nazývá se molární plynová konstanta R.R
= 8,314 J/(K .mol). Stavová rovnice ideálního plynu pro látkové množství n tak dostává konečný tvarpV = nRT
Stavová rovnice ideálního plynu byla nejprve sestavena pouze na základě experimentů. Dokázána odvozením byla mnohem později a to díky molekulové fyzice.