|
Teplo Q. Rozdíl mezi pojmy teplota a teplo nebyl dlouhou dobu jasný ani mezi vědci.
Z experimentů a pozorování však byla jasná potřeba oba pojmy rozlišovat.
Dnešní podoba definic vychází z díla Josepha Blacka z počátku 19.
století. Black jako první zdůraznil rozdíly mezi intenzivními a extenzivními
veličinami. Intenzivní faktor je například teplota a tlak. Teplo a třeba objem
řadíme mezi extensivní faktory. Pokud se soustava dostala do rovnovážného stavu, vyrovnaly se
teploty složek. I nadále však může každá složka vyžadovat jiné teplo k další
změně teploty.
Teplo soustava příjme (odevzdá), pokud ji chceme zahřát
(ochladit). Druhou a poslední možností, jak zvý šit teplotu
soustavy, je konání práce vnějších sil.
Teplo, které přijme chemicky stejnorodé těleso,
je závislé na hmotnosti tělesa a velikosti změny teploty.
Tepelná kapacita C. Tepelná kapacita udává teplo, které soustava přijala (odevzdala), aby se zahřála (ochladila) na určitou
teplotu. Je definována vztahem
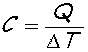
Jednotkou tepelné kapacity je joule na kelvin, značka J/K. Tepelnou kapacitu měříme obvykle za konstantního tlaku nebo
objemu. Tepelná kapacita totiž závisí na způsobu, jakým se změna udála! Její
označení pak je Cp
při konstantním tlaku nebo CV při konstantním objemu.
a) Mnohdy však
hovoříme o měrné tepelné kapacitě c. Ta je specifická pro každou látku a skupenství. Je
to tepelná kapacita vztažena na jednotku hmotnosti. Jednotka je joule na kelvin a
kilogram, značka J/(K×kg). Definiční vztah má tvar
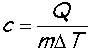
Měrná tepelná kapacita látky se udává v tabulkách pro
určitou teplotu, protože se částečně mění v závislosti na teplotě látky.
b) Molární tepelná kapacita Cm je tepelná kapacita vztažena na jednotku látkového
množství. Je rovna teplu, které příjme 1 mol látky při zahřátí o 1 kelvin.
Jednotka je joule na mol a kelvin, značka J/(mol×K)
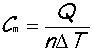

|
