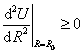![]() 6.1 Podmínky vzniku chemické vazby
6.1 Podmínky vzniku chemické vazby
Prostřednictvím elektromagnetické interakce mohou spolu atomy vytvářet vázané systémy (molekuly, clustery, pevné látky apod.). Hovoříme o chemické vazbě mezi atomy. Podle zvyklostí v chemii sice nepovažujeme za chemickou vazbu slabé mezimolekulové interakce (malá vazebná energie), nicméně níže uvedené podmínky platí i pro „slabě vázané“ systémy atomů a molekul. (Polohy atomů určujeme polohami jejich jader.)
Nutným předpokladem pro splnění podmínky rovnováhy je existence odpudivých a přitažlivých sil.
Pokud známe závislost interakční energie atomů na polohách jejich jader (viz např. adiabatické přiblížení), můžeme formulovat podmínky vzniku vazby v konkrétnější podobě.
Podmínky vzniku chemické vazby:
Nechť ![]() je interakční energie
(často označovaná jako potenciál) systému n atomů,
je interakční energie
(často označovaná jako potenciál) systému n atomů, ![]() jsou polohové vektory
jader atomů. Pro názornost uvažujme i případ dvouatomové molekuly se sféricky
symetrickým potenciálem:
jsou polohové vektory
jader atomů. Pro názornost uvažujme i případ dvouatomové molekuly se sféricky
symetrickým potenciálem: ![]() .
.
·
Podmínka rovnováhy – musí existovat
prostorová konfigurace ![]() , pro niž jsou výslednice sil
, pro niž jsou výslednice sil ![]() , jimiž ostatní atomy
působí na daný atom, pro všechny
atomy nulové:
, jimiž ostatní atomy
působí na daný atom, pro všechny
atomy nulové:
![]() , popř.
, popř.
Pro potenciál U(R) dostáváme:
·
Podmínka stability – interakční
energie ![]() musí mít pro konfiguraci
musí mít pro konfiguraci ![]() splňující podmínku
rovnováhy lokální minimum.
splňující podmínku
rovnováhy lokální minimum.
Pro potenciál U(R) stačí:
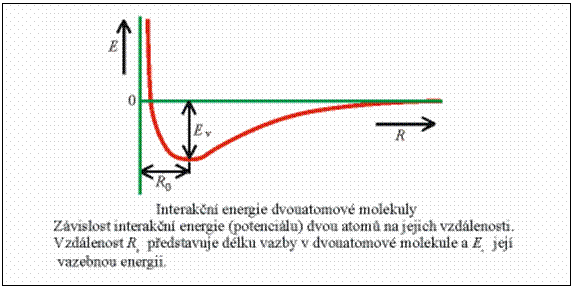
Vzdálenost atomů R0 v dvouatomové molekule se obvykle označuje jako délka vazby, ve víceatomových systémech se spíše používá termín meziatomová vzdálenost. Hodnota EV = U(R0) se označuje jako vazebná energie nebo též disociační energie (vazby, resp. dvouatomové molekuly).
Nutnou podmínkou existence minima v závislosti interakční energie je existence přitažlivých a odpudivých sil mezi atomy. Jejich význam nejlépe objasníme opět na případu dvouatomové molekuly.
Přitažlivé síly ![]() převládají nad
odpudivými na vzdálenostech větších než je délka vazby a hrají důležitou roli
při vytváření chemické vazby – pokud se atomy přiblíží na určitou vzdálenost,
musí se začít přitahovat.
převládají nad
odpudivými na vzdálenostech větších než je délka vazby a hrají důležitou roli
při vytváření chemické vazby – pokud se atomy přiblíží na určitou vzdálenost,
musí se začít přitahovat.
Podstatu přitažlivých sil objasňují teorie chemické vazby, které se liší podle typu vazby v molekule. Původ sil je třeba hledat hlavně v interakci elektronových obalů atomů.
Odpudivé síly ![]() naopak převládají nad
přitažlivými na vzdálenostech menších než je délka vazby a prudce rostou
zejména při těsném přiblížení jader. Zabraňují tak splynutí jader atomů a
vytvoření tzv. sjednoceného atomu. Ve vzdálenosti R0 musí dojít k vyrovnání účinku obou typů sil, tak
jak to vyžaduje podmínka rovnováhy.
naopak převládají nad
přitažlivými na vzdálenostech menších než je délka vazby a prudce rostou
zejména při těsném přiblížení jader. Zabraňují tak splynutí jader atomů a
vytvoření tzv. sjednoceného atomu. Ve vzdálenosti R0 musí dojít k vyrovnání účinku obou typů sil, tak
jak to vyžaduje podmínka rovnováhy.
Původ odpudivých sil je třeba hledat zejména
v elektrostatickém odpuzování kladně nabitých jader. Při velmi těsném
přiblížení odpovídá závislost odpudivých sil alespoň přibližně Coulombovu
zákonu, při větších vzdálenostech ubývají
podstatně rychleji než coulombické síly, což je dáno tím, že kladný elektrický
náboj jader je částečně stíněn záporně
nabitým elektronovým obalem atomu. Empiricky je možné potenciál odpudivých sil
popsat potenciálem Yukawova
typu: ![]() , kde a a k jsou konstanty (a je analogií členu
, kde a a k jsou konstanty (a je analogií členu ![]() v coulombickém
potenciálu a k je tzv. stínící
konstanta). Více se ale používá potenciál mocninný:
v coulombickém
potenciálu a k je tzv. stínící
konstanta). Více se ale používá potenciál mocninný: ![]() , kde a a n jsou konstanty (n bývá většinou přirozené číslo, nejčastěji 12).
, kde a a n jsou konstanty (n bývá většinou přirozené číslo, nejčastěji 12).
Řádově
rozměr atomu.
Označovaný též jako stíněný Coulombův potenciál.
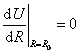 .
.