V této kapitole bude naším úkolem podrobněji vyšetřit a pochopit chování soustavy kapalina-pára v okolí kritického bodu.
Vyjdeme ze stavu přehřáté páry a budeme sledovat děj izotermického stlačování této páry. Průběh děje bude záviset podstatně na tom, jakou teplotu má přehřátá pára, je-li totiž pod kritickou teplotou nebo nad ní.

Vyšetříme nejprve případ, kdy teplota páry .
Kondenzaci lze provést tak, že stlačujeme přehřátou páru pístem ve
válci, který je v lázni, jejíž teplotu udržujeme stálou. Průběh děje je
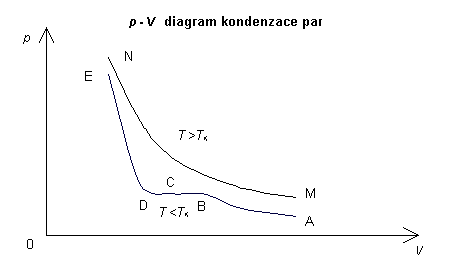
znázorněn v grafu 10. Za stavu A je ve válci jen
přehřátá pára. Při zmenšování objemu tlak roste. Za stavu B dosáhl tlak
páry tlaku syté páry, na dně válce se objeví vrstvička kapaliny. Ve stavech
C, D syté páry ubývá a kapaliny přibývá, tlak syté páry zůstává stálý,
rovný tlaku p sytých par při teplotě T (nezávisle na objemu
páry). V okamžiku kdy zkapalnila poslední syté pára, v nádobě zůstala jen
kapalina. Další stav E znamená již stlačování této kapaliny. Protože je
kapalina málo stlačitelná, roste její tlak při dalším zmenšování objemu
velmi prudce.
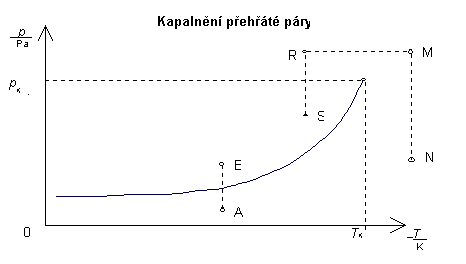
Byla-li však teplota páry větší než teplota kritická (),
bude průběh děje jiný (graf 9). Stlačujeme-li páru
izotermicky roste tlak a hustota páry, ale látka zůstává ve stavu plynném
(stav N). Chceme-li ji zkapalnit, musíme ji nejdříve ochladit pod kritickou
teplotu (děj N-M-R) a pak popřípadě snížit tlak (děj R-S). Přechod z páry
v kapalinu je nepozorovatelný, je-li kapalina i plyn čirá. V obrázku je
znázorněno (obdobně obr.) tak, že z teček znázorňujících původně řídký
plyn (stav M), se stává plyn hustý (stav N), který pak po ochlazení přechází
v kapalinu spojitě, bez zřetelného vytvoření rozhraní kapaliny a páry -
obrázek 1.
V grafu 10 jsou p-V diagramy (izotermy) obou dějů. Při prvním ději roste tlak přehřáté páry z A do B přibližně podle stavové rovnice ideálního plynu (úsek hyperboly). V bodě B se stala pára sytou, kapalní, v průběhu BCD zůstává její tlak stálý (nezávisí na objemu). Ve stavu D všechna páry zkapalněla, při dalším zmenšení objemu tlak prudce roste, kapalina se stlačuje (děj DE).
Při druhém ději MN roste s klesajícím objemem tlak podle stavové rovnice (zákon Boyleův-Mariottův).
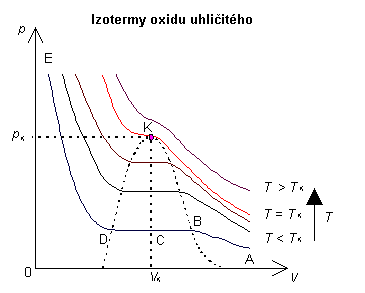
Důležité bude vyšetřování izoterm v okolí kritického stavu kapaliny
- graf 11. To provedl nejprve Andrews pro kysličník
uhličitý CO2, jehož kritická teplota je 31,1°C. Průběh izoterm
pro některé teploty je v grafu 11. Pod kritickou
teplotou je průběh obdobný průběhu ABDE, jenže obor BD, v němž koexistuje
fáze kapalná a plynná, se při zvyšování teplot postupně zužuje. Při izotermě
odpovídající kritické teplotě body BCD splynou v jediný bod K, odpovídající
kritickému stavu. Izotermy nad kritickou teplotou odpovídají izotermám
stlačovaného reálného plynu. Nechť ,
pak obor AB odpovídá plynné fázi, obor BCD koexistenci obou fází a obor
DE kapalné fázi. Nechť
,
pak při stlačování pozorujeme pouze plynnou fázi dané látky.