Skupenské teplo
Cíle experimentu:
·
Uvědomíte
si rozdíl mezi teplotou a teplem.
·
Uvědomíte si, proč se nemění teplota v kalorimetru, pokud je v něm směs
ledu a vody.
· Porozumíte pojmům: fáze, skupenské teplo, teplo a teplota, kalorimetr, změny
skupenství atd.
·
Budete
umět graficky vyjádřit závislost změny teploty soustavy na teple, které soustava
přijímá.
Teorie:
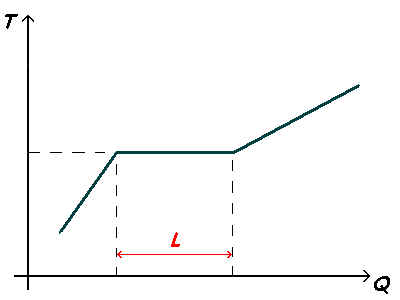
Skupenské teplo L se v některé literatuře také nazývá teplo fázové přeměny. Skupenské teplo je teplo, které homogenní těleso příjme nebo odevzdá při změně skupenství při stálé teplotě a tlaku. Jednotkou je 1 joule, značka J.
Molární
skupenské teplo Lm
je teplo potřebné k fázové změně jednoho molu látky při stálé teplotě a tlaku. Fáze se změní v
druhou fázi o téže teplotě a tlaku. Jednotkou je joule na mol, značka
J/mol.
Měrné skupenské teplo l
je teplo potřebné k fázové změně jednoho kilogramu látky při stálé teplotě a
tlaku. Fáze se změní
v druhou fázi o téže teplotě a tlaku. Jednotkou je joule na kilogram, značka
J/kg.
Podle
konkrétního přechodu pak hovoříme například o měrném skupenském teplu tání nebo
o měrném skupenském teplu tuhnutí atd. Důležité
je si uvědomit, že např. měrné teplo tání a měrné teplo tuhnutí stejné látky za
stejných podmínek mají stejné hodnoty.

Přijímá-li látka teplo, tak při určité teplotě a tlaku dojde k fázovému přechodu. Veškeré přijaté teplo způsobuje změnu skupenství. Hovoříme o skupenském teple L. Po skupenské změně celého objemu látky, tj. tání, varu, bude přijímané teplo způsobovat zvýšení teploty kapaliny nebo páry.
Nastavení
měřicího systému:
Budete potřebovat: čidlo
teploty, led,
kahan.

Do
kalorimetru vložte kousek ledu. Potom nalijte do kalorimetru předem
odměřený objem horké vody o známé teplotě. Teplota v kalorimetru je stále
0°C, ale objem ledu se zmenšuje. Jak je to možné? Každá pevná látka, včetně
ledu, musí přijmout skupenské teplo, aby roztála. I n při ostatních změnách skupenství musí látka
přijmout nebo odevzdat skupenské
teplo.
Do
malé skleněné kádinky nasypejte asi 1 dl ledové tříště nebo sněhu. Kádinku vložte
do vodní lázně, kterou opatrně zahřívejte ohřívačem nebo kahanem.
Sledujte na monitoru, že teplota ledu roste, ale když je led zahřát na 0°C, tak se růst teploty zastaví. Veškeré přijaté teplo způsobí změnu skupenství. Po přeměně ledu ve vodu, teplota opět začne růst.
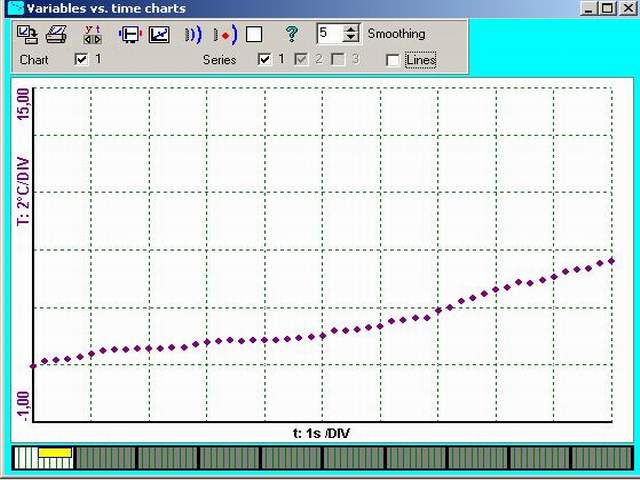
Ukázka naměřené křivky
Problémy:
·
Proč
se teplota nemění, pokud v kádince zůstává led?
· Co se stane, pokud použijeme jinou kapalinu?
· Má jev praktické použití?
Závěry:
·
Izolovaný
systém ve stavu termodynamické rovnováhy, který má ve všech částech stejné
fyzikální a chemické vlastnosti (termodynamickou teplotu T, hustotu r,
chemické složení) se nazývá fáze.
·
Termodynamický
systém může mít více fází. Příkladem je voda, led při teplotě 0°C jsou dvě
fáze.
·
Každá
látka může měnit svou fázi. Takový proces se nazývá fázová
změna.
·
Při změně skupenství látka přijímá skupenské teplo, až zcela změní své
skupenství. další přijímání tepla způsobí vzrůst teploty.
· Měrné skupenské teplo ledu je 334 000 J×kg-1.
· Měrné skupenské teplo tání a měrné skupenské teplo tuhnutí téže látky za stejných podmínek majíé stejné velikosti.