Teorie:
Plyn ve stavu termodynamické rovnováhy můžeme charakterizovat termodynamickými veličinami: termodynamickou teplotou T, tlakem p, objemem V a látkovým množstvím n nebo hmotností m. V případě konstantní termodynamické teploty T můžeme stavovou rovnici zapsat ve tvaru
![]() .
.
Izotermický děj popisuje závislost mezi objemem a tlakem ideálního plynu, pokud teplota zůstává konstantní. Tento děj se nazývá Boyleův-Marriotův zákon. Ze stavové rovnice jej vyjádříme ve tvaru p1V1 = p2V2 nebo pV = konstanta.
Křivka vyjadřující izotermický děj v pV diagramu je izoterma. Izoterma je větev hyperboly v prvním kvadrantu.
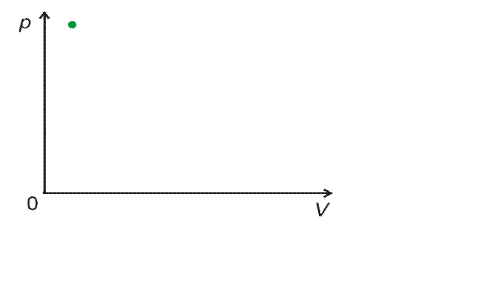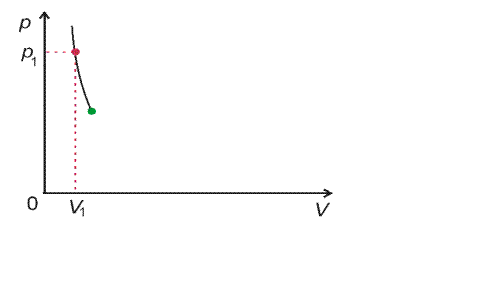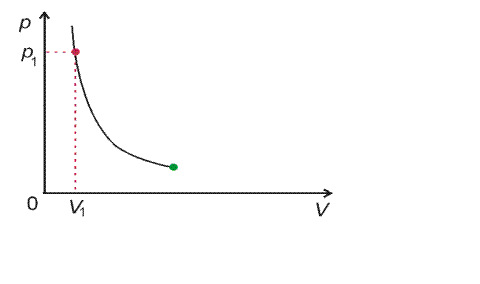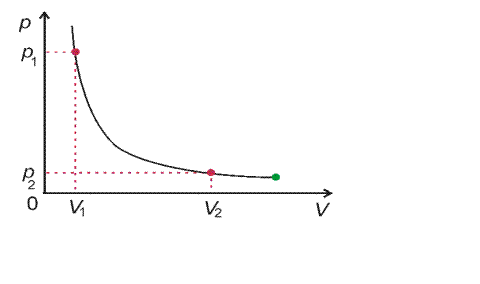
pV diagram izotermického děje
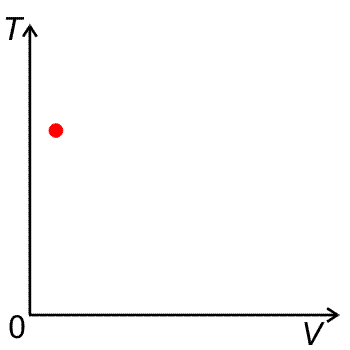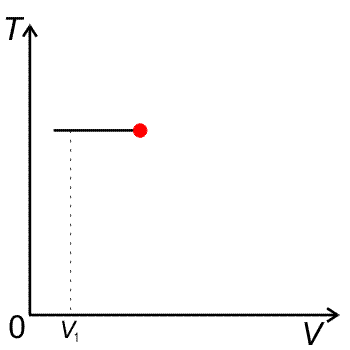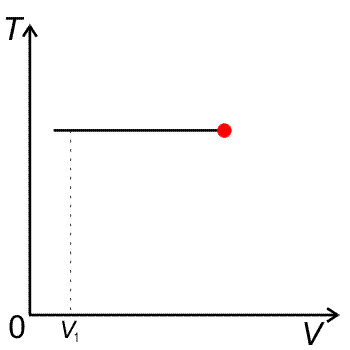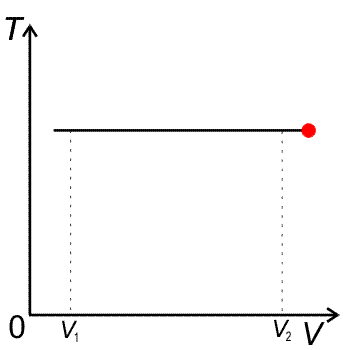
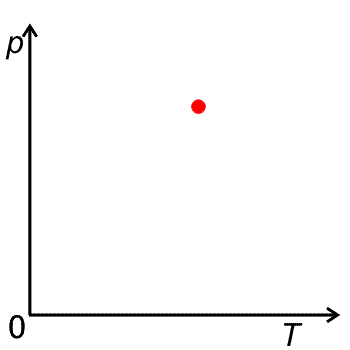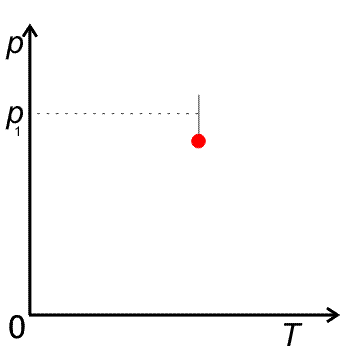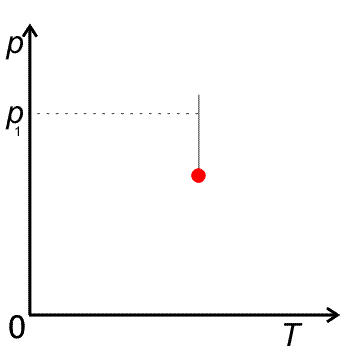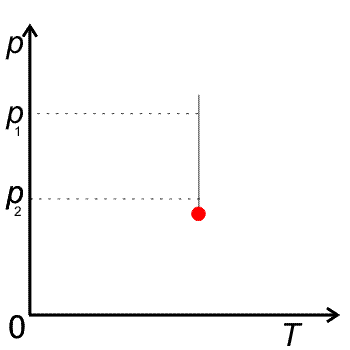
VT diagram izotermického děje (vlevo) a pT diagram izotermického děje (vpravo)
Nastavení
měřicího sytému:
Budete
potřebovat:
čidlo tlaku, čidlo teploty, soupravu pro děje v plynu včetně ohřívače.

Propojte čidlo tlaku s vývodem z válce vnitřní nádoby a
čidlo teploty do otvorů vnější nádoby. Zmenšujte objem uvnitř válce každých
pět sekund o přibližně pět mililitrů.

Ukázka naměřených křivek
Problémy:
·
Jaké
fyzikální změny můžete sledovat ve válci s plynem?
·
Jaký
je vztah mezi tlakem a objemem plynu.
· Popište vztah mezi tlakem a objemem matematicky.
· Jak by se změnil děj, kdybyste použili jiný plyn?
Závěry:
·
Izotermický děj popisujeBoyleův-Mariottův zákon jeho
vyjádření je..p1V1
= p2V2
· Pokud zajistíme ideální průběh izotermického děje, potom teplota plynu se skutečně nemění.
· Izotermický děj můžeme experimentálně provést i při jiné teplotě plynu. Grafem je opět izoterma, která je vzhledem k předcházející posunutá.