Izochorický děj
Cíle experimentu:
Budete
znát závislost mezi termodynamickou teplotou a tlakem dané soustavy.
Budete
vědět, jak je možné, že se objem soustavy nemění.
Budete
znát a chápat pojmy: izochora, ideální plyn, Charlesův zákon atd.
Budete
umět sestrojit izochoru v
pV diagramu.
Teorie:
Plyn ve stavu termodynamické rovnováhy můžeme charakterizovat termodynamickými veličinami: termodynamickou teplotou T, tlakem p, objemem V a látkovým množstvím n nebo hmotností m. Jejich vzájemné vztahy popisuje stavová rovnice ideálního plynu, kterou můžeme zapsat ve tvaru
![]()
Izochorický děj popisuje závislost mezi termodynamickou teplotou a tlakem ideálního plynu, pokud objem zůstává konstantní. Tento děj popisuje Charlesův zákon, který je vyjádřen vztahem
![]() ,
nebo
,
nebo
![]()
Izochora je křivka v pV diagramu je to úsečka rovnoběžná s osou p.
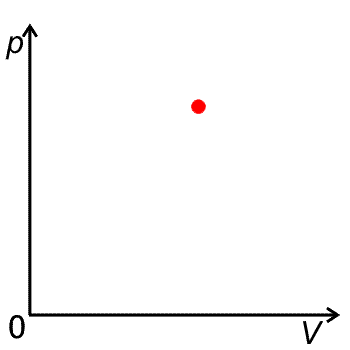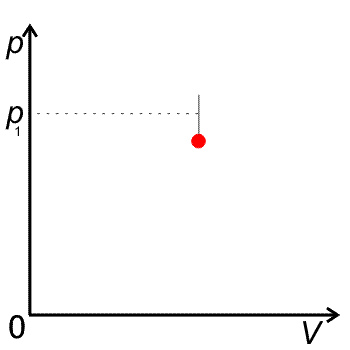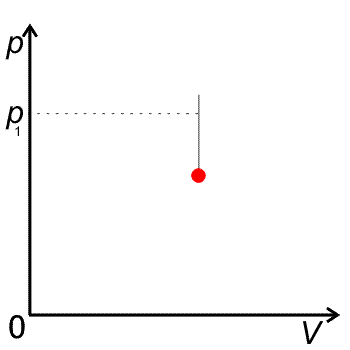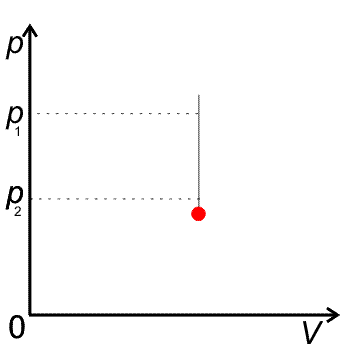
pV diagram pro izochorický děj
Nastavení
měřicího sytému:
Budete
potřebovat:
čidlo tlaku, čidlo teploty, soupravu pro děje v plynu včetně
vařiče.

Připojte čidlo tlaku na válec vnitřní nádoby a čidlo teploty vložte do otvorů vnější nádoby. Píst vnitřního válce zajistěte tak, aby se neměnil objem plynu ve válci.
Na grafu můžete vidět změny tlaku a teploty v závislosti na čase.
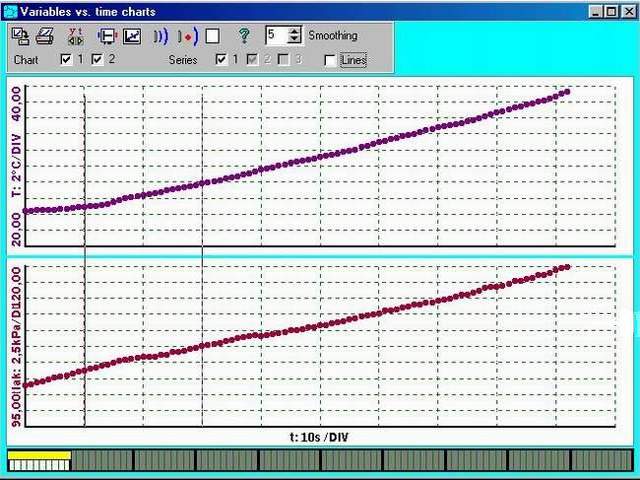
Ukázka naměřených křivek
Problémy:
·
Které
fyzikální změny probíhají ve válci?
·
Jaký
je vztah mezi tlakem a teplotou plynu při konstantním objemu?
·
Vyjádřete vztah mezi tlakem a teplotou plynu
při konstantním objemu matematicky?
·
Jak
by se změnil izochorický děje při použití jiného plynu?
Závěry:
·
Izochorický děj popisuje Charlesův zákon, je vyjádřen vztahem ![]()
· Izochorický děj můžeme provést i při jiném objemu plynu, grafem je opět izochora to je v pV diagramu rovnoběžka s osou p vzhledem k původní posunutá.
·
Plyn
ve stavu termodynamické rovnováhy popisujeme pomocí tzv. stavových veličin:
termodynamické teploty T, tlaku p, objemu V a látkového
množství n nebo hmotnosti m.