Kalorimetrická rovnice
Cíle experimentu:
Uvědomíte si rozdíly mezi pojmy skupenské teplo a teplo.
Budete
umět sestavit kalorimetrickou rovnici.
Teorie:
Kalorimetrická rovnice vyjadřuje zákon zachování energie pro daný systém. Na jedné straně rovnice jsou zapsány všechny složky, které teplo přijímají na druhé straně všechny složky, které teplo odevzdávají. Kalorimetrickou rovnici musíte pro každý speciální případ sestavit zvlášť. Kalorimetrickou rovnicí můžete popsat i změny skupenství.
Předpokládejte, že máte kalorimetr s tepelnou kapacitou C; uvnitř kalorimetru je kapalina s měrnou tepelnou kapacitou c1, hmotností m1 a teplotou T1. Potom do kalorimetru vložíte těleso o vyšší teplotě T2 s hmotností m2 a měrnou tepelnou kapacitou c2. Zákon zachování energie má tvar
Q1 + Qk = Q2,
kde , Q1 je teplo přijaté kapalinou a Qk je teplo přijaté kalorimetrem a Q2 je teplo odevzdané tělesem o vyšší teplotě. To znamená:
![]()

Kalorimetr
Nastavení
měřícího systému:
Budete potřebovat: čidlo
teploty, kalorimetr,
varnou konvici.

100 ml vlažné vody nalijte do kalorimetru. Potom
dolijte do kalorimetru horkou vodu, přidejte do vody několik kostek ledu a na
závěr i žhavý kovový váleček.
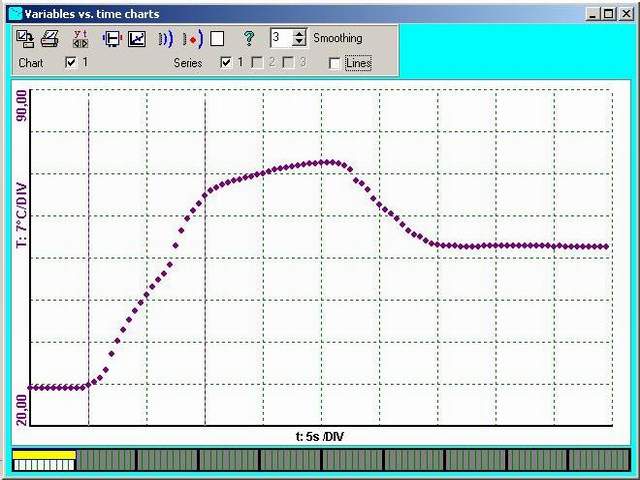
Ukázka naměřených křivek