2.3.2
Disociace
Cíl:
·
Žáci
budou znát, jaké jsou podmínky vedení proudu v elektrolytech.
·
Žáci
budou znát procesy, které doprovázejí vedení proudu v elektrolytech.
Pomůcky:
Nádoba na elektrolyt, vodný roztok NaCl, uhlíkové elektrody
(grafit) jsou připojeny k DAQ - 3 fáze: elektrody nejsou ponořeny do roztoku
NaCl, elektrody jsou ponořeny do roztoku NaCl, elektrody nejsou ponořeny do
roztoku NaCl.
Zamyšlení:
·
Jaké
procesy probíhají na elektrodách?
·
Jaké
procesy probíhají na kladné elektrodě?
·
Jaké
procesy probíhají na záporné elektrodě?
·
Jaké
procesy probíhají v elektrolytu?
Schémata:
Elektrický proud v elektrolytech je možný jen v případě
přítomnosti volných iontů. V destilované vodě je jen několik volných iontů.
Mnohem více iontů Na+ a Cl- je v vodném roztoku
soli NaCl.
- Přidejte
krystalickou sůl NaCl do destilované vody. NaCl disociuje. Polární
molekuly vody roztrhají krystaly NaCl.
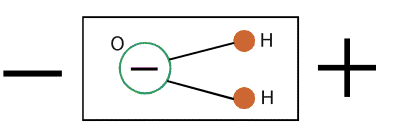
Polární molekula vody
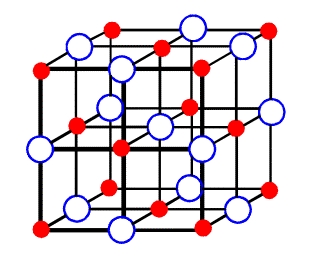
Krystal NaCl. Cl- je označena modře, Na+
je označena červeně.
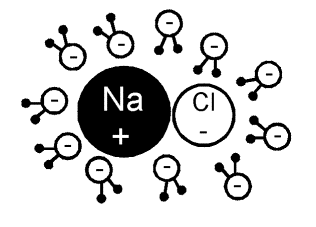
Polární molekuly vody v okolí NaCl
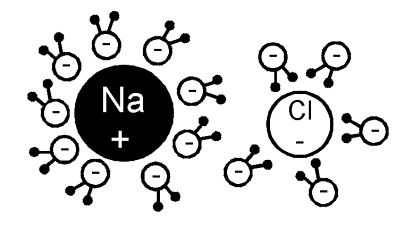
Roztržená molekula NaCl na ionty Na+
a Cl- ve vodě po disociaci
Disociace NaCl molekulami vody probíhá bez přítomnosti
vnějšího elektrického pole.
Disociace NaCl probíhá i při tavení soli za vysoké teploty,
ale k disociaci je třeba asi 80 krát větší energie.
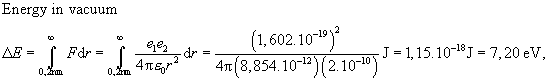
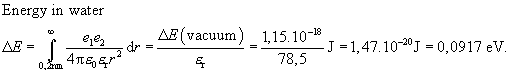
Schéma experimentu: Zapojení – roztok NaCl s uhlíkovými
elektrodami.
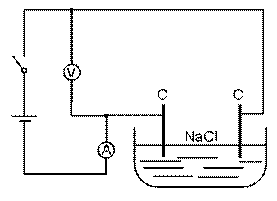
Zapojení
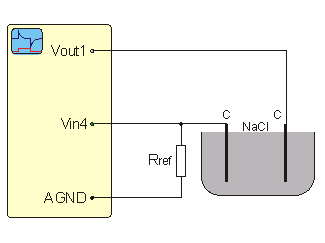
![]() Kalibrační e-ProLab soubor for
Rref = 100 W, Vin4, Vout1.
Kalibrační e-ProLab soubor for
Rref = 100 W, Vin4, Vout1.
Úlohy:
- Změřte VA charakteristiku
destilované vody.
- Popište VA charakteristiku!
- Přidejte krystaly NaCl do vody
a rozpusťte je.
- Změřte VA charakteristiku
roztoku NaCl!
- Popište VA charakteristiku
roztoku NaCl!
- Je VA charakteristika roztoku
NaCl závislost lineární?
- Jaké je rozkladné napětí?
Typické výsledky:
![]() Příklad závislosti při Rref =
100 W.
Příklad závislosti při Rref =
100 W.
![]() Příklad e-ProLab souboru
s Rref = 100 W.
Příklad e-ProLab souboru
s Rref = 100 W.